Dlaczego hydrochlorek guanidyny denaturuje białka?
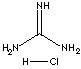 hydrochlorek guanidyny, ew. chlorowodorek guanidyny, GuHCl, GdnHCl
hydrochlorek guanidyny, ew. chlorowodorek guanidyny, GuHCl, GdnHCl
Denaturacja białek to dowolna zmiana struktury przestrzennej (konformacji) prowadząca do utraty aktywności biologicznej. Denaturację białka można uzyskać na kilka sposobów chemicznych (środki chaotropowe, detergenty, substancje redukujące mostki disiarczkowe) lub poprzez ogrzanie. Denaturacja może być odwracalna (np denaturacja środkami chaotropowymi jest odwracalna po usunięciu denaturanta np na drodze dializy lub rozcieńczenia) lub nieodwracalna (np deneturacja termiczna zwykle prowadzi do nieodwracalnej precypitacji białka z roztworu).
Hydrochlorek guanidyny jest substancją chaotropową. Chaotropy ang. chaotropes czyli ,,czyniące chaos'' to substancje, które w roztworach wodnych wprowadzają silne zaburzenie w sieci wiązań wodorowych między cząsteczkami wody. Są skuteczne tylko w dużych stężeniach (np mocznik - 8M, GuHCl - 6M). Zaburzając strukturę wody powodują, że woda przestaje oddziaływać z białkiem. Przez to struktura białka ma więcej ,,swobody'' - nie jest stabilizowana przez otaczające ją cząsteczki wody. Można powiedzieć, że środki chaotropowe (a więc m.in hydrochlorek guanidyny) ,,odwracają uwagę'' wody od cząsteczki białka. Białko zaś, mając więcej ,,wolności'' strukturalnej może wystawić residua hydrofobowe bardziej na zewnątrz (bo niekorzystne oddziaływania z wodą nie pojawią się ze względu na fakt, iż cząsteczki wody są ,,zajęte'' cząsteczkami chaotropowymi); to natomiast prowadzi do destabilizacji struktury białka i do całkowitej denaturacji.

