Dla studentów &ndash Sceny z życia cząsteczek chemicznych
Czy zastanawialiście
się nad tym, co dzieje
się w Waszym organizmie, gdy oddychacie, jecie, poruszacie się?
W każdej sekundzie miliardy cząsteczek uczestniczą w reakcjach
chemicznych, łącząc się z innymi, rozpadając,
zmieniając swoją strukturę i kształt. Nasze życie możliwe jest dzięki
niezliczonym reakcjom, w których uczestniczą
cząsteczki związków organicznych. Ale chęć zrozumienia molekularnych
podstaw życia to tylko jeden z powodów,
dla których dążymy do poznania mechanizmów rządzących reakcjami
chemicznymi. Istnieje wiele innych, bardziej
praktycznych przyczyn, jak choćby ta, że dokładna znajomość przebiegu
pewnych reakcji umożliwiłaby bardziej
wydajną syntezę leków, tworzyw sztucznych i wielu innych związków,
które ułatwiają nasze życie. Niezależnie od
motywów, którymi można kierować się badając procesy chemiczne, ich
poznawanie jest fascynującym zajęciem. By zrozumieć
te fascynację pobudźmy naszą wyobraźnię i przenieśmy się na chwilę do
mikroświata, by ujrzeć taką oto scenę:
w przestrzeni unoszą się dwie cząsteczki chemiczne, składające się z
kilkudziesięciu atomów, głównie węgla i
wodoru, tworzących skomplikowany, przestrzenny kształt. Każda z nich
otoczona jest delikatną mgiełką – to elektrony
z atomów zebrały się w chmury elektronowe, dzięki którym istnieją
wiązania chemiczne. Cząsteczki zbliżają się do
siebie, ich chmury elektronowe przenikają się i nagle coś zaczyna się
dziać! Nieruchome dotychczas atomy przemieszczają
się, struktura każdej z cząsteczek zmienia się, po chwili wydaje nam
się, że tworzą one jedną bryłę o niewyraźnym
kształcie. Wreszcie kłębowisko znów rozdziela się na dwa obiekty, lecz
nie są to już te same cząsteczki, które
obserwowaliśmy na początku. Drgania tworzących je atomów wciąż jeszcze
zdradzają, że przed chwilą uczestniczyły
w reakcji chemicznej. Jednak po pewnym czasie uspokoją się, przekazując
do otoczenia nadmiar energii, zdobyty
podczas reakcji i zgromadzony w oscylacjach szkieletu cząsteczki.
 Niestety, nie ujrzymy takiego spektaklu na własne oczy,
a strata to
wielka, bo widowisko na długo zapadłoby
nam w pamięć. Za to możemy, posługując się pośrednimi metodami,
odtworzyć wszystkie jego sceny. Zanim opiszemy,
jak w laboratoriach bada się przebieg reakcji chemicznych, spróbujmy
uświadomić sobie czas, w jakim one zachodzą.
A jest to czas niezmiernie krótki, bo mierzymy go femtosekundach.
Trudno ogarnąć myślą taką jednostkę wiedząc,
że jedna femtosekunda to 10^-15 sekundy. Z pewnością bardziej przemawia
do wyobraźni fakt, że jedna femtosekunda
ma się do jednej sekundy tak, jak 8 minut do wieku całego Wszechświata!
Nie jest łatwo badać tak krótkie procesy.
Niewiele narzędzi badawczych jest dostatecznie szybkich. Nie istnieją
zegary odmierzające tak krótkie czasy,
nie poradzi sobie z pomiarem femtosekund żadna elektronika. Istnieje
jednak coś, co jest dostatecznie szybkie,
by podglądać cząsteczki w ich ultraszybkim życiu: światło! A mówiąc
poprawniej – bardzo krótkie impulsy światła
laserowego, zwane impulsami ultrakrótkimi. Do niedawna ich wytwarzanie
i badanie samo w sobie było celem. Obecnie,
gdy poznano je już dość dobrze, zostały zaprzęgnięte do pracy i są
podstawowym narzędziem w nowej dziedzinie badań: femtochemii.
Niestety, nie ujrzymy takiego spektaklu na własne oczy,
a strata to
wielka, bo widowisko na długo zapadłoby
nam w pamięć. Za to możemy, posługując się pośrednimi metodami,
odtworzyć wszystkie jego sceny. Zanim opiszemy,
jak w laboratoriach bada się przebieg reakcji chemicznych, spróbujmy
uświadomić sobie czas, w jakim one zachodzą.
A jest to czas niezmiernie krótki, bo mierzymy go femtosekundach.
Trudno ogarnąć myślą taką jednostkę wiedząc,
że jedna femtosekunda to 10^-15 sekundy. Z pewnością bardziej przemawia
do wyobraźni fakt, że jedna femtosekunda
ma się do jednej sekundy tak, jak 8 minut do wieku całego Wszechświata!
Nie jest łatwo badać tak krótkie procesy.
Niewiele narzędzi badawczych jest dostatecznie szybkich. Nie istnieją
zegary odmierzające tak krótkie czasy,
nie poradzi sobie z pomiarem femtosekund żadna elektronika. Istnieje
jednak coś, co jest dostatecznie szybkie,
by podglądać cząsteczki w ich ultraszybkim życiu: światło! A mówiąc
poprawniej – bardzo krótkie impulsy światła
laserowego, zwane impulsami ultrakrótkimi. Do niedawna ich wytwarzanie
i badanie samo w sobie było celem. Obecnie,
gdy poznano je już dość dobrze, zostały zaprzęgnięte do pracy i są
podstawowym narzędziem w nowej dziedzinie badań: femtochemii.
Podstawowa idea femtochemii jest bardzo prosta: badaną
reakcję
chemiczną musimy rozpocząć w dobrze określonym
momencie, by po pewnym czasie wykonać „zdjęcie” cząsteczek w niej
uczestniczących. Przeprowadzając wiele
doświadczeń, w których zmieniamy opóźnienie pomiędzy „sygnałem startu”,
a momentem wykonania „zdjęcia” możemy
odtworzyć przebieg całej reakcji. Nietrudno domyślić się, że
ultrakrótkie impulsy światła są tutaj zarówno
„starterem” (tzw. impuls pompujący) jak i „migawką fotograficzną”
(impuls próbkujący).
Układ doświadczalny, w którym wykonuje się takie badania pokazany jest
na fot. 1. W dalszym ciągu skupimy się na badaniu wybranej klasy
reakcji
chemicznych: procesów izomeryzacji i tautomeryzacji zachodzących w
cząsteczkach 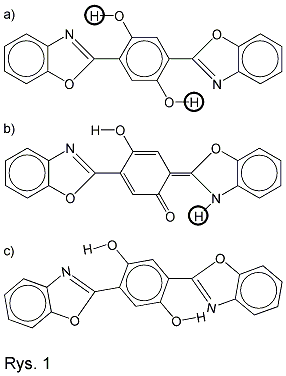 po wzbudzeniu ich światłem. Choć w reakcjach takich uczestniczy tylko
jedna cząsteczka, to nie muszą być one
uboższe niż te z udziałem większej liczby cząsteczek. Cząsteczki
organiczne nie raz już zaskoczyły nas różnorodnością
zjawisk, które mogą w nich wystąpić po pobudzeniu światłem. W
doświadczeniu tego typu część fotonów tworzących
impuls pompujący zostaje pochłoniętych przez próbkę zawierającą badane
cząsteczki. W wyniku pochłonięcia fotonów
cząsteczki ulegają wzbudzeniu do wyższego stanu energetycznego i mogą
podlegać najróżniejszym przemianom: mogą
się wyginać w różne strony, fragmenty cząsteczki mogą zbliżać się lub
oddalać, niektóre atomy mogą zmienić swoje
położenie w cząsteczce, chmura elektronowa może zmienić swój kształt.
Zmiany te obserwujemy dzięki temu, że wpływają
one na sposób oddziaływania cząsteczek z drugim impulsem, próbkującym.
po wzbudzeniu ich światłem. Choć w reakcjach takich uczestniczy tylko
jedna cząsteczka, to nie muszą być one
uboższe niż te z udziałem większej liczby cząsteczek. Cząsteczki
organiczne nie raz już zaskoczyły nas różnorodnością
zjawisk, które mogą w nich wystąpić po pobudzeniu światłem. W
doświadczeniu tego typu część fotonów tworzących
impuls pompujący zostaje pochłoniętych przez próbkę zawierającą badane
cząsteczki. W wyniku pochłonięcia fotonów
cząsteczki ulegają wzbudzeniu do wyższego stanu energetycznego i mogą
podlegać najróżniejszym przemianom: mogą
się wyginać w różne strony, fragmenty cząsteczki mogą zbliżać się lub
oddalać, niektóre atomy mogą zmienić swoje
położenie w cząsteczce, chmura elektronowa może zmienić swój kształt.
Zmiany te obserwujemy dzięki temu, że wpływają
one na sposób oddziaływania cząsteczek z drugim impulsem, próbkującym.
Wzbudzona cząsteczka, gdy zostanie oświetlona światłem,
może zachować
się dwojako: może pochłonąć kolejny foton,
tym samym zwiększając stopień wzbudzenia, albo wyemitować foton
identyczny jak ten, który na nią padł, pozbywając
się wzbudzenia i wracając do stanu podstawowego. Prawdopodobieństwo
zajścia tych procesów zależy od własności
cząsteczki i barwy światła (a mówiąc językiem fizyki – od długości fali
lub energii fotonów). Mierząc zmianę liczby
fotonów o różnych energiach w impulsie próbkującym, wywołaną
oddziaływaniem ze wzbudzonymi cząsteczkami, badamy
pośrednio przemiany w nich zachodzące.
Jakie zjawiska obserwujemy? Spójrzmy na rysunek 1, przedstawiający
cząsteczkę 2,5-bis(benzoksazol-2-yl)hydrochinonu oznaczanego
skrótem BBHQ.
W stanie podstawowym atomy wodoru otoczone kółeczkami związane są z
atomami tlenu w grupie hydroksylowej (rys. 1a). W rezultacie
doświadczeń
stacjonarnych stwierdzono, że po zaabsorbowaniu fotonu jeden z tych
atomów wodoru zostaje oderwany od atomu tlenu i
związany z atomem azotu tworzy grupę aminową (rys. 1b). Eksperymenty te
nie pozwoliły jednak
stwierdzić, w jakim czasie atom wodoru
zostaje przeniesiony, ani jakie zmiany w cząsteczce towarzyszą temu
procesowi. Natomiast w wyniku pomiarów
femtosekundowych okazało się, że istotna zmiana impulsu próbkującego
zachodzi wtedy, gdy jest on opóźniony względem
impulsu pompującego o ok. 110 fs. Ponadto widoczne są cykliczne zmiany
tego impulsu zachodzące z okresem ok. 280 fs.
Połączenie tych rezultatów z obliczeniami teoretycznymi, z których
wynika, że drganie zginające cząsteczkę BBHQ w
płaszczyźnie ma okres również bliski 280 fs, pozwoliło zaproponować
następujący mechanizm przeniesienia atomu wodoru:
Pochłonięcie fotonu przez cząsteczkę wprawia ją w ruch drgający, w
którym dwie części cząsteczki zbliżają się do
siebie (rys. 1c). Po ok. 110 fs, czyli po czasie krótszym niż połowa
okresu drgań, gdy atomy wodoru i azotu są blisko
siebie, następuje oderwanie atomu wodoru od tlenu i przyłączenie go do
azotu. Następnie fragmenty cząsteczki oddalają
się od siebie, a cząsteczka wykonuje jeszcze kilkanaście drgań o coraz
mniejszej amplitudzie. Mimo pełnej symetrii
cząsteczki, tylko jeden atom wodoru zostaje przeniesiony!
 Nie zawsze mamy do czynienia z tak jasną sytuacją, jak
w cząsteczce
BBHQ, gdzie wzbudzenie optyczne wywołuje
tylko jeden typ drgań, znajdujących odzwierciedlenie w zmianach impulsu
próbkującego.
Nie zawsze mamy do czynienia z tak jasną sytuacją, jak
w cząsteczce
BBHQ, gdzie wzbudzenie optyczne wywołuje
tylko jeden typ drgań, znajdujących odzwierciedlenie w zmianach impulsu
próbkującego.
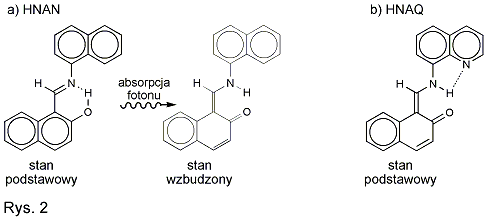
Na rysunku 2a widzimy cząsteczkę
2-hydroksynaftylideno-1'-naftyloaminy (HNAN), w której również może
zachodzić przeniesienie atomu wodoru od
tlenu do azotu. Podobnie jak w BBHQ powinny temu towarzyszyć drgania
cząsteczki, jednak w doświadczeniach
przeprowadzonych w naszym laboratorium nie widzimy okresowych zmian w
impulsie próbkującym, spowodowanych przez
te drgania. Może to oznaczać, że są one zbyt szybkie, by nasza
aparatura je zarejestrowała, lub że nie wpływają
na oddziaływanie cząsteczek ze światłem, albo też, że nie ma ich wcale.
Niezależnie od przyczyny jesteśmy w tym
wypadku pozbawieni ważnej informacji, widzimy za to inne zmiany,
świadczące o występowaniu w tej cząsteczce co
najmniej 4 różnych procesów, których charakterystyczne czasy są krótsze
niż 20 pikosekund (pikosekunda to
1000 femtosekund). Jest ich zdecydowanie zbyt wiele, by je od razu
rozszyfrować, zwłaszcza
że zmiany wywołane różnymi procesami
nakładają się na siebie. Uciekliśmy się więc do pewnej sztuczki,
polegającej na przeprowadzeniu badań cząsteczki
bardzo podobnej do HNAN, ale takiej, w której atom wodoru już w stanie
podstawowym jest połączony z azotem (rys. 2b).
Zatem w tej cząsteczce – 2-hydroksynaftylideno-(8-aminochinoliny)
(HNAQ) – nie zachodzi najbardziej
interesujący nas proces przeniesienia atomu wodoru.
Sztuczka – jak się wydaje – przyniosła efekt: w cząsteczce HNAQ widzimy
tylko 3 różne procesy, nie widzimy zaś
najszybszego, który w cząsteczce HNAN zachodził w czasie krótszym niż
100 fs. To porównanie pozwoliło nam z dużym
prawdopodobieństwem utożsamić najszybszy proces widziany w HNAN z
przeniesieniem atomu wodoru oraz stwierdzić,
że po nim występują w cząsteczce kolejne zmiany, znacznie wolniejsze,
choć wciąż bardzo szybkie.
 Badania
zjawisk zachodzących w opisanych wyżej cząsteczkach mają
potencjalnie duże znaczenie w biologii, bo
wewnątrzcząsteczkowe wiązania wodorowe, które ulegają w nich
zrywaniu i tworzeniu pod wpływem światła mają
zasadnicze znaczenie w strukturze przestrzennej DNA.
Badania
zjawisk zachodzących w opisanych wyżej cząsteczkach mają
potencjalnie duże znaczenie w biologii, bo
wewnątrzcząsteczkowe wiązania wodorowe, które ulegają w nich
zrywaniu i tworzeniu pod wpływem światła mają
zasadnicze znaczenie w strukturze przestrzennej DNA.
Na zakończenie przyjrzyjmy się jeszcze bliżej układowi,
w którym
wykonuje się opisane doświadczenia, bo wykorzystywane
są w nim zjawiska nie mniej interesujące niż te badane za jego pomocą.
Jest to konsekwencja bardzo krótkiego czasu
trwania impulsów laserowych. Choć niesiona przez nie energia jest
niewielka, mniejsza niż energia wyzwolona podczas
upadku monety jednogroszowej z wysokości 10 cm, to – ze względu na to,
że energia impulsu wyzwolona jest w niezwykle
krótkim czasie kilkudziesięciu femtosekund – chwilowa moc impulsu
osiąga gigawaty. To tyle, ile moc elektrowni
atomowej! Światło o takiej mocy oddziałuje z materią inaczej niż
światło, do którego jesteśmy przyzwyczajeni – w wyniku efektów
nieliniowych podczas propagacji przez przezroczysty i bezbarwny ośrodek
jego barwa (długość
fali) może się zmienić!  Wykorzystuje się ten
efekt do przekształcenia impulsów wytwarzanych przez laser – czerwonych
– w impulsy pompujące o dwukrotnie mniejszej
długości fali (w tzw. procesie generacji drugiej harmonicznej – fot.
2),
niezbędnej do wzbudzenia cząsteczek – niebieskie.
Jeszcze bardziej widowiskowy jest proces, w którym
powstają impulsy próbkujące. Ponieważ wzbudzone cząsteczki mogą
wprowadzać zmiany w impulsie próbkującym na różnych
długościach fal, ważne jest, by impuls ten zawierał jak najwięcej
różnych długości fal. Przy tak wielkich mocach, z
jakimi mamy tu do czynienia, spełnienie tego warunku jest bardzo proste
– wystarczy czerwone impulsy światła
laserowego skierować na szklaną płytkę, a powstaną w niej impulsy
światła białego (tzw. superkontinuum – fot. 3), zawierające wszystkie
długości
fal z zakresu widzialnego! Femtochemia jest więc wspaniałym przykładem
tego, że badania podstawowe w jednej
dziedzinie – optyce – mogą okazać się bezcenne z punktu widzenia
zastosowań w zupełnie innej dziedzinie – chemii.
Wykorzystuje się ten
efekt do przekształcenia impulsów wytwarzanych przez laser – czerwonych
– w impulsy pompujące o dwukrotnie mniejszej
długości fali (w tzw. procesie generacji drugiej harmonicznej – fot.
2),
niezbędnej do wzbudzenia cząsteczek – niebieskie.
Jeszcze bardziej widowiskowy jest proces, w którym
powstają impulsy próbkujące. Ponieważ wzbudzone cząsteczki mogą
wprowadzać zmiany w impulsie próbkującym na różnych
długościach fal, ważne jest, by impuls ten zawierał jak najwięcej
różnych długości fal. Przy tak wielkich mocach, z
jakimi mamy tu do czynienia, spełnienie tego warunku jest bardzo proste
– wystarczy czerwone impulsy światła
laserowego skierować na szklaną płytkę, a powstaną w niej impulsy
światła białego (tzw. superkontinuum – fot. 3), zawierające wszystkie
długości
fal z zakresu widzialnego! Femtochemia jest więc wspaniałym przykładem
tego, że badania podstawowe w jednej
dziedzinie – optyce – mogą okazać się bezcenne z punktu widzenia
zastosowań w zupełnie innej dziedzinie – chemii.
Badanie ultraszybkich reakcji chemicznych jest bardzo
prężną nauką.
Choć nagroda Nobla została już przyznana –
Ahmedowi Zewailowi w roku 1994 za prace w dziedzinie femtochemii
prowadzone w latach 80. XX wieku – to wciąż
opracowywane są nowe techniki doświadczalne pozwalające badać coraz
bardziej skomplikowane i coraz szybsze procesy.
Miejmy nadzieję, że kiedyś osiągną one taki poziom, że o dowolnej
reakcji chemicznej będziemy mogli mówić tak,
jakbyśmy jej przebieg widzieli na własne oczy.
Literatura:
1. P. Fita, E. Luzina, T. Dziembowska, D. Kopeć, P. Piątkowski, Cz.
Radzewicz, A. Grabowska, Keto-enol tautomerism of two structurally
related Schiff bases: direct and indirect way of creation of the
excited keto tautomer , Chem, Phys. Lett. 416, 305-310 (2005).
2. P. Fita, E. Luzina, T. Dziembowska, Cz. Radzewicz, A. Grabowska,
Chemistry, photophysics and ultrafast kinetics of two structurally
related Schiff bases containing the naphthalene or quinoline ring ,
J. Chem. Phys. 125, 184508 (2006).
Piotr Fita

Powrót